Mnカタラーゼの反応機構と活性部位形成のメカニズムの解明 (担当: 高野)
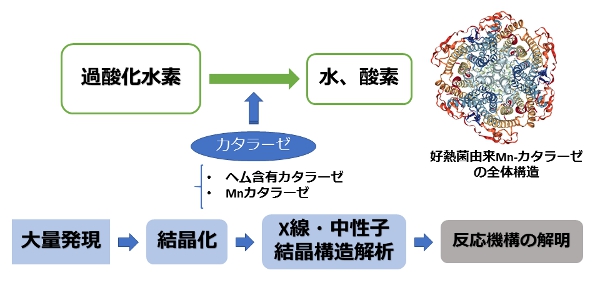
有毒な酸素代謝物である過酸化水素の不均化を触媒する酵素であるカタラーゼには、すでに研究が進んでいるヘム含有のもの以外にヘムを含まないMnカタラーゼが存在します。原核生物に幅広く存在するMnカタラーゼは、鉄欠乏下やわずかな酸素分圧下、あるいはシアン化物下で活性を示し、ヘム含有カタラーゼと一線を画します。当研究ではX線および中性子結晶構造解析によりMnカタラーゼ触媒作用の反応中間体および変異体の立体構造を明らかにすることでその「反応機構の解明」を目指します。またそれに伴い、中性子結晶構造解析に用いる結晶の調製に要する「大腸菌による大量発現系の確立」も目指しています。
過酸化水素の有害な影響は、加齢や癌、神経変性疾患など生物学的過程において多くの研究で確認されており、当研究の進展によりこれを無害化する合成触媒のデザインに役立てたいと考えています。
ニッケル置換型ルブレドキシンのX線・中性子結晶構造解析 (担当: 横山)
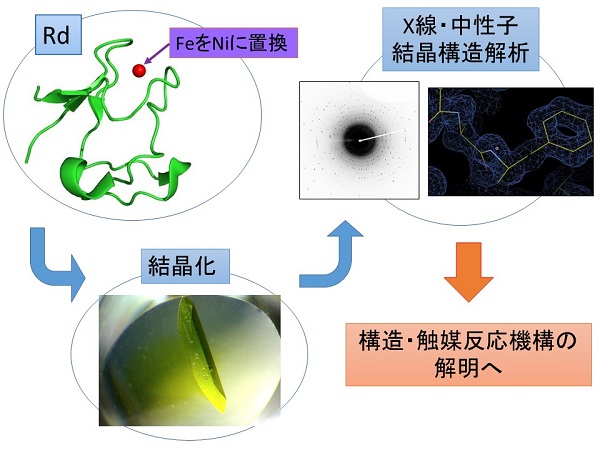
本研究ではルブレドキシン(Rd)というタンパク質を研究対象としています。Rdは多くの細菌に見だされており、生体内の電子伝達反応に関与しています。このタンパク質は活性中心にFeを1つ持っているのが特徴ですが、このFeを人工的にNiに置換したルブレドキシン(NiRd)はプロトンと電子から水素を合成する水素生成触媒としての機能をもつことがわかっています。しかしこの反応機構はまだ明らかにされておらず、また現在報告されているNiRdはわずかな生物種由来のものだけです。そのため、本研究では様々な生物種由来のNiRdを結晶化しX線・中性子構造解析を行うことで、構造や触媒反応機構の解明を目指しています。近年、CO2排出を伴わないクリーンなエネルギーとして水素が注目されており、水素の製造・利用のための触媒技術の開発が必要とされています。現在の水素合成の主な方法は化石燃料を用いる方法ですが、NiRdを水素合成触媒として利用することができれば、太陽光を用いる持続可能な新しいエネルギーシステムの構築が期待されます。